TRANSCRIPCION DE CITOQUINAS EN LINFOCITOS B DE VACAS INFECTADAS CON EL VIRUS DE LA LEUCOSIS BOVINA
Marcel Amills 1, Junzo Norimine 2, Colleen A. Olmstead 2 y Harris A. Lewin 2
1 Unitat de Genètica i Millora, Departament de Patologia i Producció Animals, Facultat de Veterinària, Universitat Autònoma de Barcelona, Bellaterra 08193. 2 Laboratory of Immunogenetics, 210 Department of Animal Sciences, 1201 West Gregory Drive, Urbana, IL 61801, USA
INTRODUCCION
La función inmunológica de los linfocitos B no se limita a la secreción de anticuerpos antígeno-específicos, sinó que una vez activados también son capaces de interactuar con otras células del sistema inmune mediante la secreción de citoquinas (Pistoia 1997). La caracterización de los perfiles de transcripción de citoquinas en linfocitos B "in vivo" y en líneas celulares tumorales, tanto en humano como en ratón, ha revelado que dicho patrón de transcripción se halla jerarquizado en dos niveles distintos: un primer nivel que incluye citoquinas que se transcriben abundantemente tanto "in vivo" como "in vitro" (p.e. factor de necrosis tumoral y linfotoxina
a) y un segundo nivel de citoquinas que sólo se transcriben "in vitro"(p.e. interleuquina 2 e interleuquina 5) (Pistoia 1997). Esta información ha resultado de gran ayuda para entender como los linfocitos B son capaces de gobernar su proliferación y diferenciación e intervenir en la formación de los centros germinales (Pistoia 1997, Chaplin y Fu 1998). Igualmente, la observación de que en determinadas enfermedades tumorales, autoinmunes e infecciosas los linfocitos B presentan un patrón de secreción de citoquinas anormal ha contribuido a entender los mecanismos biológicos que las desencadenan (Pistoia 1997). Con la finalidad de definir los perfiles de secreción de citoquinas en linfocitos B bovinos, se ha llevado a cabo el presente trabajo. Para ello se han aislado linfocitos B en vacas infectadas con el virus de la leucosis bovina (VLB+) y que presentaban una expansión policlonal de linfocitos B CD5+ en sangre periférica, denominada linfocitosis persistente (LP+) (Radke 1994). Este modelo experimental resulta ideal puesto que en los animales con linfocitosis persistente existe un porcentaje sustancial de linfocitos B activados tanto "in vivo" como "in vitro" (Matheise et al. 1992). Nuestro análisis transcripcional ha incluido las citoquinas factor de necrosis tumoral (TNF), linfotoxina a (LT-a), factor de crecimiento transformante ß1 (TGF-ß1), interleuquina 1ß (IL-1ß), interleuquina 6 (IL-6) e interleuquina 10 (IL-10), y se ha realizado tanto "in vivo" como "in vitro".
MATERIAL Y METODOS
Para este estudio se seleccionaron 7 vacas Holstein-Friesian VLB+LP+. Se procedió a aislar los linfocitos totales según Mirsky et al. (1996). Los linfocitos B se resuspendieron a una concentración de 50 millones de linfocitos/ml de tampón salino fosfatado (PBS, pH 7.4), y se incubaron con 4
µg/ml de un anticuerpo monoclonal murino IgG1 anti-inmunoglobulina M bovina (BIg73A, VMRD Inc.), durante 45 min a 4ºC. Se eliminó el exceso de anticuerpo con 3 lavados con 4 ml de PBS (400g/10 min) y se añadieron 150 millones de partículas magnéticas Dynalbeads 45 µM (Dynal), recubiertas de anticuerpo anti-IgG1 murino (4ºC / 45 min). Utilizando un imán MPC (Dynal), se aislaron los linfocitos B que se habían unido a las partículas Dynalbeads. Los linfocitos B se separaron mecánicamente de las partículas Dynalbeads mediante aspiración repetida con una jeringa de tuberculina de 1 ml. El análisis por citometría de flujo de las preparaciones así obtenidas demostró que contenían >98% de linfocitos B. La mitad de los linfocitos B fueron resuspendidos en 1 ml de Trizol (Gibco BRL), mientras que la fracción restante fue cultivada durante 16 horas en medio RPMI-1640 suplementado con un 20% de suero fetal bovino, a una concentración de 2.5 millones de linfocitos B/ ml medio (37ºC, 5% CO2). Una vez terminado el periodo de cultivo, los linfocitos B se resuspendieron en 1 ml de Trizol (Gibco BRL) y se procedió a extraer el ARN siguiendo las instrucciones del proveedor.La síntesis del ADN complementario (ADNc) se efectuó mediante transcripción reversa en un volumen de reacción de 50
µl que contenía tampón RT (25 mM Tris.Cl pH 8.3, 37.5 mM KCl, 1.5 mM MgCl2), 1 mM ditiotreitol, 250 µM de cada desoxirribonucleótido (dNTP), 100 pmol oligo dT16 y 400 U de transcriptasa reversa del virus de la leucemia murina Moloney (Gibco BRL). El perfil térmico fue de 65ºC/10 min - 42ºC/60 min - 94ºC/10 min. El análisis transcripcional incluyó las siguientes citoquinas: IL-1ß (5'-cacccgtgcagtcaataaag-3', 5'-cttgatacccaaggccacag-3'), IL-6 (5'-ccactg ctggtcttctggag-3', 5'-ctcaggctgaactgcagg-3'), IL-10 (5'-ctgtctgacagcagctgtatcc-3', 5'-ccagtgagttcacgtgctcctt-3'), TNF(5'-tctcaagcctcaagtaacaagc-3', 5'-tggtgtgg gtgaggaacaag-3'), LT-a (5'-tgacaccacctggacgtctc-3', 5'-ggagggaattgttgctcaga-3') y TGF-ß1 (5'-agagaggaaatagagggctt-3', 5'-atgaatccacttccagccca-3'). El gen de la gliceraldehido deshidrogenasa-3-fosfato (GAPDH) se utilizó como control de la eficiencia de la reacción de RT (5'-tctcgctcctggaagatggt-3', 5'-gaaggtcggagtcaacggat-3'). El gen de la proteina viral Tax se utilizo como indicador de la expresion del VLB ("primers"descritos en Mirsky et al. 1993). Las reacciones de amplificación por PCR se efectuaron en un volumen de 50 µl que contenía tampón de PCR (10 mM Tris.Cl pH 8.3, 50 mM KCl), 2.5 mM de MgCl2, 0.2 µM de cada oligonucleótido, 200 µM de dNTPs, 5 µl de reacción RT y 1 U de Taq ADN polimerasa (Perkin Elmer). El perfil térmico fue 94ºC/4 min, seguido de 33 ciclos de 94ºC/1min - 57ºC/1 min - 72ºC/1 min y un último ciclo de extensión de 72ºC/5 min. Se cuantificó la cantidad de producto de PCR mediante electroforesis en gel de poliacrilamida al 6% y análisis densitométrico con un sistema digital AlphaImager IS-1000 (Alpha Innotech Corp.).
RESULTADOS Y DISCUSION
Nuestros resultados indican que los genes de las citoquinas TNF, LT-
a y TGF-ß1 se transcriben "in vivo" de forma constitutiva, mientras que los genes IL-1ß, IL-6 e IL-10 se transcriben a niveles prácticamente indetectables en nuestras condiciones experimentales (Figura 1). En la especie humana, TNF y TGF-ß1 potencian e inhiben la proliferación de los linfocitos B, respectivamente (Boussiotis et al. 1994, Kehrl et al. 1986). La transcripción simultánea de dos citoquinas con funciones biológicas opuestas establecería un mecanismo homeostático a través del cual los linfocitos B bovinos podrían modular los procesos de división celular y diferenciación. La expresión constitutiva de TNF y LT-a por los linfocitos B bovinos resulta de interés en un contexto de inmunología comparada, puesto que en el ratón estas dos citoquinas resultan esenciales para regular la organización espacial de las células dendríticas en los centros germinales (Chaplin y Fu 1998). Resultados preliminares indican que linfocitos B bovinos aislados a partir de tumores sólidos tambien transcriben TNF, LT-a y TGF-ß1 ARNm de forma constitutiva. La secreción de TGF-ß, un potente factor inmunosupresivo, por celulas neoplásicas explicaría por qué dichos tumores son capaces de eludir los mecanismos de vigilancia inmune mediados por los linfocitos T. Asimismo, la secreción de TNF, que es un potente factor mitogénico para los linfocitos B, favorecería la proliferación anormal que caracteriza al proceso de transformación neoplásica.Cuando los linfocitos B son cultivados durante 16 horas, la transcripción de los genes IL-1ß, IL-6 e IL-10 se activa de forma muy marcada (Figura 2). En ovejas infectadas con el VLB, el porcentaje de linfocitos B en fase S es aproximadamente del 0.33% "in vivo", mientras que este porcentaje se incrementa hasta el 10% después de 24 horas de cultivo (Schwartz et al. 1997). Ello indica que en animales VLB+LP+, los linfocitos B proliferan de forma espontánea "in vitro" y que, probablemente a través del mismo mecanismo, son capaces de activar la transcripción de citoquinas que no se transcriben o se transcriben a niveles muy bajos "in vivo". La producción endógena de IL-6 e IL-10 contribuye a la diferenciación de linfocitos B humanos activados a través de la molécula CD40 (Burdin et al. 1995). Además, la secreción de IL-10 por los linfocitos murinos B CD5+ resulta necesaria para asegurar su supervivencia en sangre periférica (O'Garra et al. 1992). Nosotros sólo detectamos una expresión significativa de IL-10 ARNm en linfocitos B cultivados, lo cual sugiere que la importancia de esta citoquina como factor autocrino de crecimiento y diferenciación de los linfocitos B CD5+ bovinos probablemente sea marginal. Aunque la expresión del VLB en linfocitos B infectados se halla reprimida "in vivo", al cabo de unas pocas horas de mantenerlos en cultivo se activa de forma muy marcada (Rad ke 1994). El análisis cinético de la transcripción de IL-1 , IL-6 e IL-10 indica que el incremento en la transcripción de IL-6 y IL-10 es muy rápido (3 horas), en cambio la activación de la transcripcion de la IL-1
ß y de la proteina viral Tax no comienza hasta al cabo de 6 horas. Estos resultados sugieren que la activación de la transcripción de IL-6 y IL-10 no depende de la expresion del VLB. De acuerdo con esta hipótesis, resultados preliminares evidencian que el patron de secreción de citoquinas en linfocitos B de vacas no infectadas con el VLB es el mismo que en vacas VLB+LP+. En definitiva, la demostración de que los linfocitos B bovinos son capaces de transcribir citoquinas tanto "in vivo" como "in vitro", provee los fundamentos para explorar con mayor profundidad la significacion de este mecanismo en el desarrollo de la respuesta inmune humoral.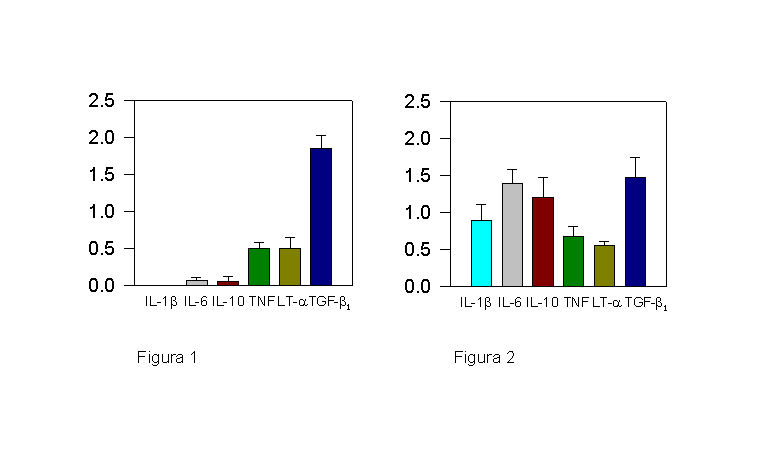
REFERENCIAS BIBLIOGRAFICAS
Boussiotis et al. 1994. Proc. Natl. Acad. Sci. USA 91: 7007-7011.
Burdin et al. 1995. J. Immunol. 154: 2533-2544.
Chaplin y Fu. 1998. Curr. Op. Immunol. 10: 289-297.
Kehrl et al. 1986. J. Immunol. 137: 3855-3860
Matheise et al. 1992. Leukemia 6: 304-309.
Mirsky et al. 1993. PCR Methods and Appl. 2: 333-340
Mirsky et al. 1996. J. Virol. 70: 2178-2183.
O'Garra et al. 1992. Eur. J. Immunol. 22: 711-717.
Pistoia. 1997. Immunol. Today 18: 343-350.
Radke. 1994. Encyclopedia of Virology, (Webster R.G. y Granoff A. Eds.) Vol. 1, pp. 166-174
Schwartz et al. 1997. J. Gen. Virol. 78: 153-162